Ley General de los Gases y Gases Ideales
La ley combinada de los gases o ley general de los gases es una ley de los gases que combina la ley de Boyle, la ley de Charles y la ley de Gay-Lussac. Estas leyes matemáticamente se refieren a cada una de las variables termodinámicas con relación a otra mientras todo lo demás se mantiene constante. La ley de Charles establece que el volumeny la temperatura son directamente proporcionales entre sí, siempre y cuando la presión se mantenga constante. La ley de Boyle afirma que la presión y el volumen son inversamente proporcionales entre sí a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la temperatura y la presión, siempre y cuando se encuentre a un volumen constante
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
donde:
k es la constante (con unidades de energía dividido por la temperatura).
La ley de los gases combinados se pueden utilizar para explicar la mecánica que se ven afectados de presión, temperatura y volumen. Por ejemplo: los acondicionadores de aire,refrigeradores y la formación de nubes.
LA ECUACIÓN GENERAL DE LOS GASES
Fue Gay - Lussac quien unifico las tres leyes: la ley de Boye Mariotte (a T cte) y las dos leyes de Gay Lussac (a P cte y a V cte), enunciando la ecuación general de los gases. Nos da la relación entre la presión volumen y temperatura de una determinada masa de gas.
Esta ecuación general de los gases ideales globaliza las tres leyes estudiadas en una sola ecuación, que nos indica que:
Utilizando R la ecuación de estado de los gases para 1 mol de sustancia quedará:

Gases Ideales
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal. Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
Empíricamente, se observan una serie de relaciones entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834.
La ecuación de estado
La ecuación que describe normalmente la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es:
Donde:
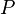 = Presión absoluta(medida en atmósferas)
= Presión absoluta(medida en atmósferas) = Volumen (en esta ecuación el volumen se expresa en litros)
= Volumen (en esta ecuación el volumen se expresa en litros) = Moles de Gas
= Moles de Gas = Constante universal de los gases ideales
= Constante universal de los gases ideales = Temperatura absoluta
= Temperatura absoluta
Teoría cinética molecular
Esta teoría fue desarrollada por Ludwig Boltzmann y Maxwell. Nos indica las propiedades de un gas ideal a nivel molecular.
- Todo gas ideal está formado por N pequeñas partículas puntuales (átomos o moléculas).
- Las moléculas gaseosas se mueven a altas velocidades, en forma recta y desordenada.
- Un gas ideal ejerce una presión continua sobre las paredes del recipiente que lo contiene, debido a los choques de las partículas con las paredes de este.
- Los choques moleculares son perfectamente elásticos. No hay pérdida de energía cinética.
- No se tienen en cuenta las interacciones de atracción y repulsión molecular.
- La energía cinética media de la translación de una molécula es directamente proporcional a la temperatura absoluta del gas.
En estas circunstancias, la ecuación de los gases se encuentra teóricamente:
donde κB es la constante de Boltzmann, donde N es el número de partículas.
Ayuda memoria para recordar la ecuación general de los gases ideales
Centro de Bachillerato Tecnológico industrial y de servicios # 37
Equipo # 10
Física 2
Prof: Salvador Acosta Bordas
Integrantes:
Christian Alejandro Campos Hernandez
Paul Zuriel Gastelum Castro
Carmen Natiely Sagaste Ramirez
Brenda Vianey Rosas Monteon
Cecilia Castillo Zamora












No hay comentarios:
Publicar un comentario